nblot 技术指标是一种在分子生物学和生物化学领域广泛应用的实验方法,主要用于检测和定量特定核酸分子(如DNA或RNA)的存在与表达水平,该技术结合了分子杂交与免疫学检测原理,通过特异性探针与目标核酸的结合,实现对目标分子的精准识别与信号放大,具有高灵敏度、高特异性的特点,在基因表达分析、病原体检测、肿瘤标志物筛查等领域发挥着重要作用。
nblot 技术指标的基本原理
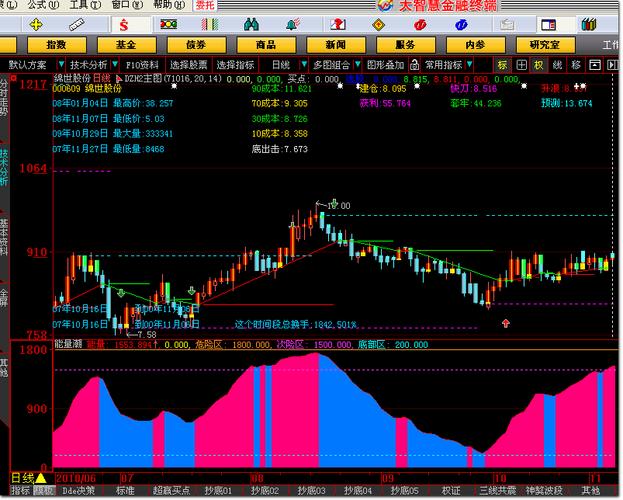
nblot 技术的核心原理基于核酸分子间的碱基互补配对特性,实验中,首先将待测样本中的核酸分子通过变性处理(如加热或碱处理)解离为单链,然后通过电泳或斑点杂交方式将其固定于固相支持膜(如硝酸纤维素膜或尼龙膜)上,随后,使用标记有报告分子(如放射性核素、酶、荧光素等)的特异性探针与膜上的核酸分子进行杂交,探针会与目标序列通过氢键形成稳定的杂交双链,通过检测报告分子的信号强度,间接反映目标核酸的含量或表达水平。
根据检测目标的不同,nblot 技术主要分为Northern blot(检测RNA)、Southern blot(检测DNA)和Western blot(检测蛋白质,虽不直接检测核酸但常联合使用),Northern blot 是研究基因转录表达的经典方法,可区分不同大小的转录本,分析剪切变异;Southern blot 则常用于基因组DNA的限制性酶切片段分析,如基因突变、重排检测等。
nblot 技术的关键步骤与技术指标
nblot 技术的实验流程复杂且对操作精度要求较高,每个步骤的技术指标直接影响结果的准确性和可靠性,以下是关键步骤及其核心指标:
样本制备与核酸提取
- 样本类型与质量:根据研究目的选择组织、细胞或体液样本,确保样本新鲜或妥善保存(如-80℃冷冻),避免RNA酶(针对Northern blot)或DNA酶(针对Southern blot)降解。
- 核酸纯度与完整性:通过紫外分光光度计检测A260/A280比值(理想值为1.8-2.0,表明蛋白质污染少)和A260/A230比值(>2.0,排除有机溶剂残留);通过琼脂糖凝胶电泳检测核酸条带完整性,如RNA应清晰显示28S rRNA和18S rRNA条带(亮度比约2:1),DNA应无弥散拖尾。
- 核酸定量:采用分光光度法、荧光定量法(如Qubit)准确测定核酸浓度,确保上样量一致(通常Northern blot上样量为10-30 μg总RNA,Southern blot为5-20 μg DNA)。
核酸分离与膜固定
- 电泳条件:Northern blot需使用变性胶(含甲醛或甲酰胺)防止RNA二级结构影响迁移,电压与电泳时间根据片段大小调整(如1 kb片段需5-6 V/cm电泳2-4小时);Southern blot使用常规琼脂糖凝胶,电泳后需用HCl处理使DNA片段变性(断裂为单链)。
- 转膜效率:转膜方法包括毛细管转移、电转或真空转膜,需确保核酸从凝胶完全转移至膜上,可通过转膜后染色(如亚甲蓝染色RNA或溴化乙锭染色DNA)检测凝胶中残留核酸量,转膜效率应>95%。
- 膜封闭:转膜后用预杂交液(含鲑鱼精DNA、牛血清白蛋白等)封闭膜的非特异性结合位点,避免探针非特异吸附,封闭时间通常为1-2小时(37℃或42℃)。
探针设计与标记
- 探针特异性:探针长度通常为200-500 bp,需与目标序列高度同源(避免非特异性杂交),可通过BLAST验证特异性,针对Northern blot,探针可设计于外显子交界处以区分不同转录本;Southern blot探针需覆盖潜在酶切位点区域。
- 标记方法与效率:常用标记方法包括随机引物法(适用于DNA探针)、切口平移法或体外转录法(适用于RNA探针),标记效率需通过放射性计数(如³²P探针)或荧光强度检测(如地高辛探针),确保比活度>10⁸ cpm/μg(放射性探针)或检测灵敏度符合要求。
- 探针纯化:标记后需通过凝胶电泳或柱纯化去除未标记的核苷酸,避免背景信号过高。
杂交与洗涤
- 杂交条件:杂交温度(Tm值)根据探针与目标序列的GC含量计算(Tm=69.3+0.41(GC%)-600/探针长度),通常在Tm值-5℃至Tm值-25℃下杂交(如42℃或65℃),杂交时间6-16小时,杂交液中需含SSC(盐溶液)、SDS(去污剂)及甲酰胺(降低杂交温度)。
- 洗涤严格性:洗涤是去除非特异性结合探针的关键步骤,需控制盐浓度(SSC浓度)和温度(如0.1×SSC+0.1% SDS,65℃洗涤2次,每次15分钟),洗涤后可通过放射自显影或荧光扫描初步判断杂交效果,背景信号应较低且特异性条带清晰。
信号检测与定量分析
- 检测方法:放射性探针使用X光片放射自显影或磷屏成像;非放射性探针(如酶标记)通过化学发光底物(如ECL)或显色反应(如NBT/BCIP)检测;荧光探针需使用荧光扫描仪。
- 定量指标:通过图像分析软件(如ImageJ、Quantity One)测定条带灰度值,以内参基因(如GAPDH、β-actin)或管家基因为对照,计算目标核酸的相对表达量(目标基因灰度值/内参灰度值),需确保信号强度在检测线性范围内(避免饱和或过弱),变异系数(CV)应<15%。
nblot 技术的优缺点与应用场景
优点
- 高特异性:基于核酸互补配对和严格洗涤条件,可区分高度同源的序列(如基因家族成员)。
- 信息完整性:可同时检测目标分子的大小与丰度,如Northern blot可识别不同剪切异构体,Southern blot可检测基因重排。
- 结果可靠:作为经典方法,其技术流程成熟,结果可重复性强,常作为金标准验证其他技术(如qPCR)。
缺点
- 操作繁琐耗时:流程包含电泳、转膜、杂交等多个步骤,通常需3-5天完成。
- 灵敏度有限:相比qPCR或数字PCR,nblot的检测灵敏度较低(约0.1-1 pg),低丰度分子难以检出。
- 样本需求量大:需微克级核酸,对珍贵样本(如活检组织)不友好。
应用场景
- 基因表达研究:分析特定基因在不同组织、发育阶段或处理条件下的转录表达水平(如Northern blot检测癌基因mRNA表达)。
- 基因结构与变异分析:Southern blot用于基因组DNA限制性酶切片段多态性(RFLP)分析、基因缺失或重排检测(如地中海贫血基因突变筛查)。
- 病原体检测:通过特异性探针检测病毒、细菌等病原体的核酸(如HPV DNA分型)。
相关问答FAQs
Q1: Northern blot与RT-PCR在检测RNA表达时有何本质区别?
A1: 两者的核心区别在于检测原理与信息维度,Northern blot通过核酸杂交直接检测总RNA中的特定转录本,可反映RNA的完整性、大小(如区分剪切异构体)及相对丰度,但灵敏度较低且操作繁琐;RT-PCR则通过逆转录将RNA合成cDNA,再经PCR扩增后检测,属于间接检测,灵敏度极高(可检测单拷贝基因),但无法提供RNA大小信息,且易受扩增效率影响,Northern blot是“终点检测”,结果直观;RT-PCR为“实时检测”,可进行绝对定量,但需依赖标准曲线。
Q2: 如何优化nblot实验中的背景过高问题?
A2: 背景过高主要源于非特异性杂交或洗涤不充分,可通过以下措施优化:① 增强封闭效果:增加封闭时间(如过夜)或使用封闭剂浓度(如BSA从5%提高至10%);② 优化探针设计:避免探针序列含重复序列或高GC区域,必要时进行片段化处理;③ 严格洗涤条件:提高洗涤温度(如从42℃升至65℃)、降低盐浓度(如从2×SSC降至0.1×SSC)或增加洗涤次数;④ 减少探针用量:适当降低探针浓度(如稀释10倍),避免过量探针导致非特异性结合;⑤ 使用高质量膜:选择低背景的尼龙膜(如Hybond-N+),避免硝酸纤维素膜的非特异性吸附。