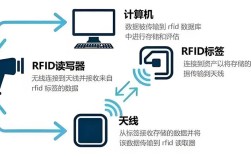
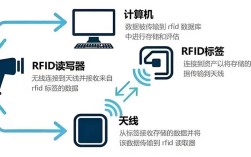
尽管Northern blot技术在基因表达研究领域具有里程碑式的意义,能够特异性地检测特定RNA分子的存在、大小和丰度,但其在实际应用中暴露出诸多缺点,限制了其在现代分子生物学研究中的广泛应用,这些缺点主要体现在操作繁琐、灵敏度低、定量准确性差以及对样本质量要求苛刻等方面。
Northern blot技术操作流程极其复杂且耗时,从RNA提取、凝胶电泳、转膜、杂交到信号检测,整个实验周期通常需要3-5天,且每一步都需精心操作,稍有不慎便会导致实验失败,RNA提取过程中极易受RNase污染导致降解,凝胶电泳时RNA的完全变性及避免二级结构形成对电泳条件要求苛刻,转膜效率的高低直接影响后续检测结果,而杂交步骤中预杂交、杂交、洗膜等条件的优化也需要耗费大量时间,这种繁琐的操作不仅增加了实验成本,也降低了实验效率,难以满足高通量筛选的需求。
Northern blot技术的灵敏度相对较低,难以检测低丰度表达的RNA分子,传统同位素标记探针的检测极限通常在1-2pg,虽然化学发光法有所提高,但对于某些稀有转录本仍显不足,这主要是因为在转膜过程中,RNA会有一定损失,且杂交过程受背景噪音影响较大,导致弱信号难以与背景有效区分,相比之下,实时荧光定量PCR(qPCR)等技术能够检测到fg级别的RNA,灵敏度远高于Northern blot。
第三,Northern blot技术的定量准确性较差,尽管通过扫描杂交条带的光密度值可以进行半定量分析,但该方法受多种因素影响,如上样量的均一性、转膜效率、探针特异性、曝光时间等,导致结果重复性不佳,即使采用内参基因进行校正,也难以完全消除这些误差,Northern blot通常只能提供RNA相对丰度的信息,对于绝对定量的需求难以满足。
Northern blot对样本质量要求极为严格,需要完整的、未被降解的高质量总RNA或mRNA,任何RNA的_partial_降解都会导致杂交条带出现异常,如拖尾或额外条带,从而干扰结果判读,这对样本采集、储存和提取过程提出了很高的要求,增加了实验的难度和不确定性。
另一个显著缺点是Northern blot的通量极低,每次实验只能检测少量样本(通常几个到十几个),且一次只能针对一种或少数几种RNA进行检测,如果要分析多个基因或多个样本,需要重复进行大量实验,工作量巨大,这与现代生物学研究中高通量、大规模的基因表达分析趋势严重不符。
Northern blot需要事先知道目标RNA的部分序列以设计和制备探针,这对于未知序列或新发现的RNA分子难以应用,探针的设计与标记过程也需要额外的时间和成本,且不同探针的杂交条件可能存在差异,进一步增加了实验的复杂性。
为更直观地展示Northern blot技术的主要缺点,以下表格进行了总结:
| 缺点类别 | 具体表现 |
|---|---|
| 操作繁琐耗时 | 流程复杂(3-5天),步骤多,对操作者技能要求高,难以高通量筛选。 |
| 灵敏度低 | 难以检测低丰度RNA(通常pg级别),转膜损失和背景噪音影响弱信号检测。 |
| 定量准确性差 | 半定量分析受多种因素影响,重复性不佳,难以实现准确定量。 |
| 样本质量要求高 | 需要高质量、完整RNA,易受降解影响,导致结果判读困难。 |
| 通量低 | 每次检测样本少,单次实验只能针对少数基因,无法满足大规模分析需求。 |
| 探针依赖性与成本 | 需已知序列设计探针,探针设计与标记耗时耗成本,不同探针条件需优化。 |
相关问答FAQs:
问:Northern blot技术与RT-qPCR相比,在检测低丰度RNA时存在哪些主要劣势?
答:Northern blot技术在检测低丰度RNA时主要存在两大劣势:一是灵敏度较低,其检测极限通常在pg级别,而RT-qPCR通过指数级扩增,灵敏度可达fg级别,能轻松检测到Northern blot无法发现的稀有转录本;二是Northern blot的整个流程(包括转膜和杂交)会导致RNA损失,且背景噪音较高,进一步削弱了对低丰度信号的检测能力,而RT-qPCR在封闭管中进行,减少了污染和损失,信号检测更为特异和灵敏。
问:为什么说Northern blot技术的定量准确性不如现代基因表达检测技术?
答:Northern blot技术的定量准确性不足主要源于其固有的实验误差来源,上样量的微小差异、RNA在转膜过程中的效率损失、杂交条件的波动以及洗膜严格程度的变化等,都会直接影响杂交条带的信号强度,传统的光密度扫描法进行半定量时,线性范围较窄,且易受饱和效应影响,相比之下,RT-qPCR采用荧光信号实时监测,通过Ct值进行定量,具有更宽的线性范围和更高的重复性;而RNA-seq等高通量测序技术则能提供更全面的定量信息,且数据标准化更为成熟,因此它们的定量准确性远高于Northern blot。